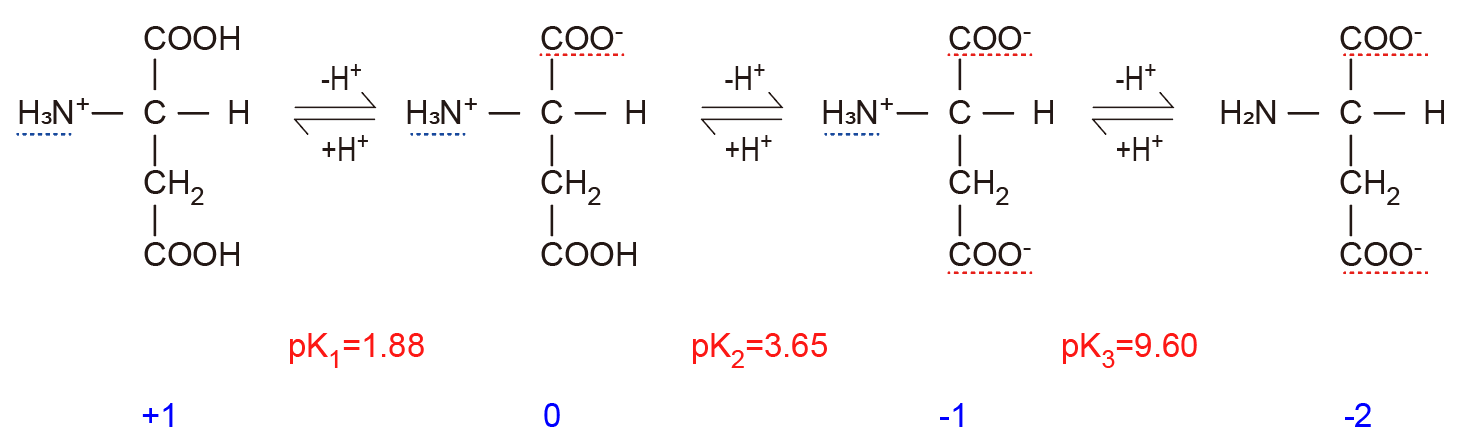
アスパラギン酸の場合-03
アスパラギン酸は,四つの平衡状態をとると考えられますが中和する地点を想像しましょう.

N+RC N+RC- N+R-C- NR-C-
A B C D
CとDの間
ここはないですね.
A:0~+1
B:0
C:0~-1
D:0~-2
の値をとるので可能性はほとんど0です.
Dの-2をどうやってもAの+1,Bの-1でまかなえないですね.
逆に,Dを無視すれば,AとCのバランスで決まります.
そうなると....大体pH=3ぐらいでしょうか...
そのときのDの割合は,
\(\Large \frac{ [A^{-}]}{[A^{-}]+[HA]} =\frac{ 1}{1+10^{9.6-3}} = 2.51 \times 10^{-7} \approx 0 \)
となり,厳密な計算以外には考えなくてもいいのです.
となると...指揮は簡単.
\(\Large pH = \frac{pK_1 + pK_2}{2} =\frac{1.88+3.65}{2} =2.765\)
となり,厳密な計算と一致します.
次に,私がまだ解決できていない問題をお示しします.